El glioblastoma es un agresivo tumor maligno que representa alrededor del 15 % de todos los tumores cerebrales. Incluso si el cáncer está en un principio controlado mediante un tratamiento, casi siempre vuelve. Las intervenciones quirúrgicas y la radioterapia pueden prolongar algunos meses la supervivencia, pero, por lo general, el cáncer cerebral causa la muerte dentro del primer o segundo año desde el diagnóstico, y menos del 5 % de las personas sobreviven más de cinco años. Igual que el glioblastoma, muchos cánceres de cráneo son difíciles de tratar debido a la sensibilidad del tejido cerebral normal a las intervenciones quirúrgicas y la radioterapia. Sin embargo, cabe esperar que esto cambie pronto, en parte gracias a nuevas terapias facilitadas por aceleradores que producen fuentes intensas de neutrones.
“Si uno piensa en llevar a cabo una reacción nuclear, probablemente no imagine que la cabeza humana sea el lugar más indicado para hacerlo, pero se equivoca”, señala Ian Swainson, Físico Nuclear del OIEA que está ayudando a formular orientaciones del OIEA relativas a aplicaciones de los aceleradores para producir neutrones, por ejemplo, en el ámbito de la medicina. El Sr. Swainson afirma que la aplicación de esta tecnología resulta muy prometedora por lo que respecta a una terapia contra el cáncer concreta: la terapia por captura neutrónica en boro (BCNT). “En determinados cánceres de cabeza, cuello y cerebro, lanzar neutrones a los átomos de boro puede salvar vidas”.
La BCNT se vale del poder destructivo que pueden desatar los neutrones y se basa en localizar lo máximo posible el daño que se producirá en el tumor. Gracias a los isótopos de boro 10, es posible aprovechar la capacidad destructiva de los neutrones. “El boro 10 no es radiactivo, y es excelente capturando neutrones. Así, en una reacción nuclear muy localizada, el boro se divide en dos fragmentos con energía. De ese modo, al inyectar a un paciente fármacos especiales que suministren boro 10 a los puntos donde se encuentre el tumor, estamos apuntando directamente contra el cáncer”, explica el Sr. Swainson.
La disponibilidad de la BCNT, todavía en una fase en gran medida experimental, es limitada, pero la situación está cambiando. En 2020, se iniciaron tratamientos clínicos en dos instalaciones de BCNT situadas en Koriyama y Osaka (Japón). Ese mismo año, el OIEA y la Universidad de Okayama (Japón) acordaron cooperar más en relación con la BCNT organizando eventos, intercambiando conocimientos e información y desarrollando una base de datos de instalaciones de BCNT.
“La BCNT es una vanguardista terapia contra el cáncer afirmó entonces Hirofumi Makino, Rector de la Universidad de Okayama. Es la unión feliz de la física nuclear moderna y la biología celular farmacéutica más actualizada. Ahora bien, no hemos de olvidar el largo historial de dificultades en el desarrollo de esta complicada tecnología médica”.
En 2001, el OIEA preparó un informe técnico sobre la BCNT que se convirtió en una obra de referencia en la materia. En ese momento, las únicas fuentes de neutrones que se utilizaban eran los reactores de investigación. Desde entonces, se ha desarrollado una nueva generación de fuentes de neutrones basadas en aceleradores compactos, que se pueden instalar directamente en las clínicas. Esto hizo que el interés por la BCNT se reavivara notablemente.
También existen proyectos relacionados con la BCNT en la Argentina, China, Finlandia y la República de Corea. “Hace 20 años, tratar el cáncer con neutrones procedentes de aceleradores solo era una teoría. Hoy es una realidad, y estamos dejando constancia de este avance en un documento técnico titulado Advances in Boron Neutron Capture Therapy, que está por publicarse”, dice el Sr. Swainson.
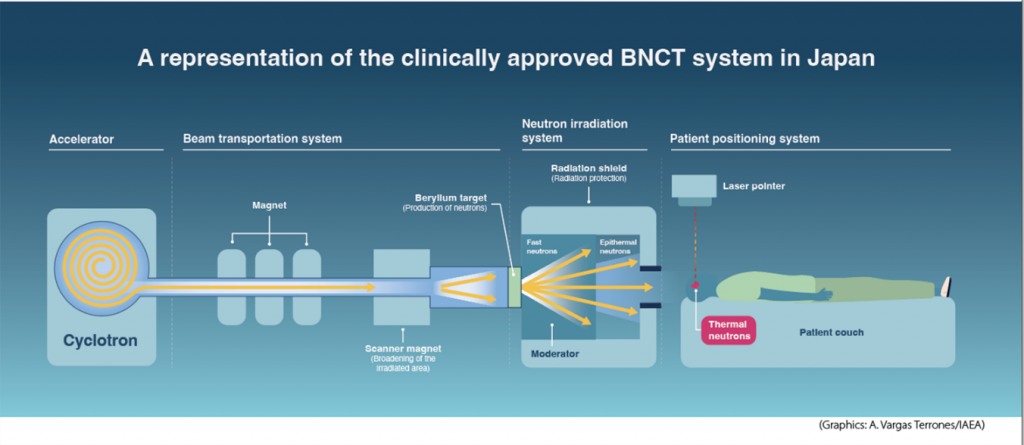
Para determinar la viabilidad de la BCNT en un paciente se le ha de inyectar un compuesto de boro radiomarcado con flúor 18 (18F), producido con ciclotrones, y se le ha de someter después a imagenología sirviéndose de una técnica de medicina nuclear llamada tomografía por emisión de positrones-tomografía computarizada (PET–TC). El compuesto marcado con 18F se denomina 4-borono-2-18F-fluoro-fenilalanina, o FBPA.
“El FBPA cumple una función importante, ya que confirma a los médicos que el tumor ha absorbido el compuesto con boro y está listo para la BCNT. Sin este paso, la terapia podría no funcionar. A medida que aumente la disponibilidad de la BCNT, necesitaremos que los ciclotrones sigan el ritmo de la demanda de FBPA”, declara Amirreza Jalilian, químico del OIEA especializado en radioisótopos y radiofármacos. Un ciclotrón es un tipo de acelerador de partículas que, lanzando un haz de partículas a isótopos estables, produce radioisótopos utilizados en medicina nuclear. Esa interacción produce una reacción nuclear en la que se crean radioisótopos de período corto. Como estos decaen rápidamente, hay que producirlos cerca del lugar donde se llevará a cabo el tratamiento o directamente en él, y usarlos de inmediato.
El Sr. Jalilian observa que, si bien el número de reactores de investigación usados en la producción de radioisótopos es bastante estable, hay un auge mundial de ciclotrones nuevos, versátiles y cada vez más asequibles. Muchos de los radioisótopos de período corto usados en pacientes pueden ser producidos por ciclotrones en hospitales, y he ahí una importante ventaja de esta tecnología.
La fluorodesoxiglucosa radiofarmacéutica es solo un ejemplo. Se basa en 18F, que puede producirse con ciclotrones. Ese radiotrazador se utiliza en alrededor del 95 % de los procedimientos de PET-TC, y es por tanto crítico en la neuroimagenología y el diagnóstico del cáncer [1].
La terapia por captura neutrónica de boro (Boron Neutron Capture Therapy, BNCT) es una modalidad de tratamiento binario que brinda una manera de destruir selectivamente células tumorales sin dañar al tejido normal circundante. La misma se basa en las reacciones de captura nuclear y posterior fisión que ocurren cuando, luego de la administración de compuestos borados, el boro-10 (10B), isótopo natural no radiactivo del elemento boro, es irradiado con neutrones térmicos de baja energía (< 0.4 eV) para producir su activación a 11B, que decae liberando una partícula α (
4 He) y un núcleo de litio-7 en retroceso (7 Li). Debido a que estas partículas de alto LET (Linear Energy Transfer) tienen un alcance limitado en el tejido (5-9 µm), sus efectos destructivos son limitados a las células que contienen boro
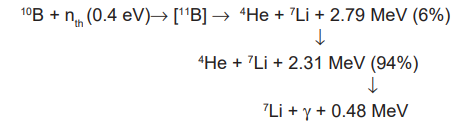
Para que este tratamiento resulte efectivo, se deben cumplir una serie de pautas:
1) la concentración de boro en el tumor en el momento de la irradiación tiene que estar en el rango entre 15 y 25 µg 10B/g de tejido (ppm).
2) la captación del compuesto de boro utilizado debería ser al menos tres veces mayor en el tumor que en la sangre y que en los tejidos normales circundantes.
3) la farmacocinética del compuesto, en cuanto a la persistencia de boro en el tumor, debe ser compatible con el tiempo necesario para completar la irradiación.
4) el compuesto borado usado no debe ser tóxico. Aunque numerosos compuestos de boro han sido sintetizados, hasta el momento sólo dos de ellos han sido utilizados en ensayos clínicos, el di-sodio-undecahidromercapto-closo-dodecarborato (BSH) y la p-hidroxiborofenilalanina (BPA). Por otro lado, en cuanto a los neutrones, el haz utilizado debe ser el apropiado. Debido a que la energía de los neutrones es atenuada en los tejidos, la energía inicial de los mismos debe ser suficiente para alcanzar el sitio del tumor con una energía menor a 0.4 eV. En este sentido, para tumores superficiales un haz de neutrones térmicos es suficiente, pero para tumores localizados profundamente en el cuerpo, se requiere un haz de neutrones epitérmicos con energías entre 0.4 eV y 10 KeV. Otro aspecto importante a tener en cuenta es que el campo de radiación producido durante BNCT es muy complejo, una mezcla de componentes de alto y bajo LET. Además de la reacción de captura neutrónica en boro 10B (n, α) 7Li, otros elementos presentes en el tejido, en proporciones importantes, capturan neutrones. Estos elementos son el hidrogeno y el nitrógeno [1 H (n, γ) 2 H y 14 N(n, p) 14C]. Además, en el haz hay también presentes radiación gamma y neutrones rápidos. Estos últimos colisionan con núcleos de hidrógeno y producen protones con una energía similar a la producida por la captura en nitrógeno. Por lo tanto la dosis física total absorbida será la suma de la dosis específica debida al boro y todas las demás contribuciones. Debida a que el haz de neutrones no puede ser colimado por sufrir dispersión en los tejidos, la dosis de neutrones a entregar al volumen del blanco, estará limitada por la tolerancia de los tejidos normales a la dosis inespecífica [2].
[1] https://www.iaea.org/es/bulletin/neutrones-para-las-neuronas-y-ciclotrones-para-los-radioisotopos