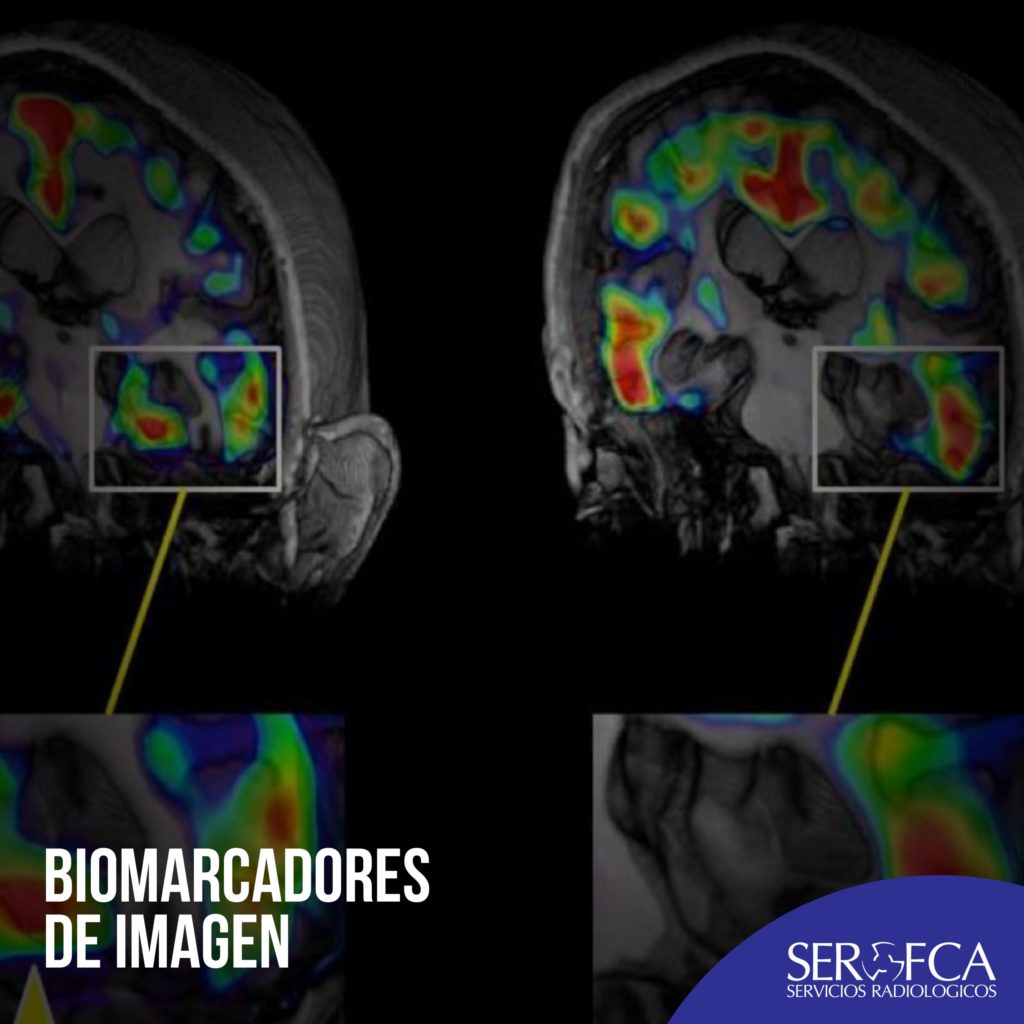
Biomarcadores de imagen
La Radiología cuantitativa y los biomarcadores de imagen se desarrollan a partir de la implantación de la imagen digital. Las imágenes médicas planares o 2D están formadas por píxeles. Un píxel, acrónimo del inglés picture element, es la menor unidad homogénea que forma parte de la imagen digital. Los píxeles son los puntos de contraste de estas imágenes, siendo la escala de grises una gama de color monocromática y las escalas de colores las diferentes plantillas colorea-das. Las imágenes digitales se forman como una matriz de píxeles, o mapa de bits, cuya sucesión lógica marca la coherencia de la información representada en la imagen y cuyo valor representa el promedio de la información en ese punto para un espesor de corte determinado. En el caso de las imágenes planares, como la radiografía simple y la gammagrafía, este espesor representa todo el volumen examinado. En estas imágenes digitales cada píxel se codifica mediante un conjunto de bits de longitud determinada, llamada profundidad o rango dinámico. Usualmente en Medicina se codifica un píxel con un byte de 8 bits, de manera que cada píxel admite hasta 256 variaciones de color en su representación visual. La señal original que se adquiere de un sujeto debe pues escalar para que se ajuste a esta escala dinámica de posibles valores, aunque el dato intrínseco original del píxel siempre se mantiene para su posible tratamiento posterior. El vóxel, del inglés volumetric pixel, es la unidad cúbica que compone una imagen tridimensional o 3D. El vóxel representa la mínima unidad procesable en una matriz tridimensional de datos, siendo el equivalente del píxel en un espacio 2D. Estas imágenes digitales son la base de la Radiología, y permiten obtener un modelo preciso en tres dimensiones del cuerpo humano como objeto de estudio para así representarlo en las pantallas de los ordenadores.
Las imágenes médicas digitales están estandarizadas en su formato. Se conoce como DICOM, acrónimo del inglés Digital Imaging and Communication in Medicine, al patrón mundialmente aceptado para el intercambio y almacenamiento de las imágenes y los exámenes radiológicos. Este formato está pensado para universalizar el manejo, visualización, almacenamiento, impresión y transmisión de las imágenes y sus metadatos asociados. El estándar DICOM incluye la definición de un formato de fichero y un protocolo de comunicación. El fichero tiene una cabecera que codifica la información pertinente al paciente, el episodio, la prueba, y la técnica de adquisición. Este fichero DICOM incluye la imagen digital, que es la imagen radiológica propiamente dicha. Así, el formato DICOM permite la integración en un único sistema de los diferentes equipos, servidores, estaciones de trabajo y hospitales en una red de múltiples proveedores. Este sistema de información es una base de datos, conocida como PACS por su acrónimo Picture Archiving and Communication System, que puede estar centralizada en el hospital pero también dispersa en nodos distantes mientras se cumpla con normativas adecuadas respecto al almacenamiento seguro y la distribución eficiente de las imágenes médicas a dónde se necesiten. El desarrollo universal de la imagen DICOM y de los sistemas PACS de almacenamiento de la información digital han sido cruciales para el avance del procesado de imágenes y el impulso a los biomarcadores de imagen subrogados (Biomarkers Definitions Working Group, 2001)
Las imágenes de Resonancia Magnética han creado la base de muchos de los desarrollos utilizados en el procesado digital de las imágenes médicas. Esta técnica diagnóstica ha madurado durante las tres últimas décadas hasta convertirse en una modalidad diagnóstica muy versátil y extremadamente útil, aceptada hoy en día como el patrón de referencia en múltiples entidades nosológicas dada su excelente representación anatómica de los tejidos blandos y su demostración de las diversas lesiones en todos los sistemas y órganos. Un ejemplo es su inclusión como criterio diagnóstico en entidades tan diferentes como la Esclerosis Múltiple o la Displasia Arritmogénica del Ventrículo Derecho. Una de las características principales de la RM es su alta sensibilidad a una gran cantidad de factores fisiológicos y biológicos que son la base de su extraordinaria sensibilidad y capacidad de tipificación tisular.
La capacidad de la Resonancia Magnética de variar las secuencias de pulso con las que se adquieren las imágenes, las técnicas de adquisición, para así modificar y controlar el brillo del píxel y el contraste de la imagen en función del componente de información que predomine en la señal, la hacen extraordinariamente interesante para la investigación académica, clínica e innovadora en medicina. Así, podemos obtener imágenes de Resonancia Magnética que estén potenciadas principalmente en densidad protónica (DP) o en los tiempos de relajación longitudinal y transversal (T1, T2, T2*). Pero también imágenes en las que domine la información de la captación de contraste, que expresen las diferencias de fase en la precesión por el movimiento macroscópico de los protones, por la susceptibilidad magnética o por el grado de sensibilidad a la magnetización. O bien imágenes en las que domine el efecto sobre el brillo del vóxel del desplazamiento químico debido al apantallamiento electrónico molecular, de la supresión o excitación selectiva de la grasa o del agua, de la transferencia de magnetización entre el agua libre y la ligada, de la difusión molecular del agua microscópica, la espectroscopía e incluso que sea este brillo de la imagen proporcional a la temperatura local del tejido estudiado. Los avances más recientes en el diseño de nuevas secuencias de pulso y en la construcción de equipos con intensidades de campo y sistemas de gradientes de campo cada vez más potentes han hecho que la Resonancia Magnética no se considere sólo como una modalidad clínica de diagnóstico, sino también como una herramienta clave en la investigación biológica y traslacional.
La Tomografía Computarizada, con sus unidades Hounsfield, y la Ecografía, con las adquisiciones dinámicas tras la administración de un contraste y la elastografía, también han contribuido, aunque en menor grado, al auge y desarrollo de los biomarcadores de imagen en Medicina.
Estas imágenes médicas, adquiridas con los equipos actualmente disponibles, generan una extensa información que, bien estructurada, es muy útil en la asistencia a los pacientes. La expansión masiva de la potencia de cálculo computacional ha permitido aumentar la velocidad y la capacidad de procesamiento de las imágenes médicas y la calidad del modelado de su señal. Este progreso genera una información cuantitativa que no podía visualizarse previamente en las imágenes fuente originales y que representan la aportación radiológica a un tratamiento seguro, personalizado y eficiente (Lee CI, 2010; Martí-Bonmatí L, 2009). Además de los biomarcadores de imagen, el procesado digital de las imágenes médicas puede generar una información sobre su estructura que se conoce como Radiómica. Este término se refiere a las características multidimensionales extraídas de las imágenes, tanto fuente como derivadas, que pueden explotarse por técnicas de minería de datos (Gillies RJ, 2016).Así, por ejemplo, si conocemos la influencia que la presencia de hierro, grasa y agua tienen en la magnitud de señal de un vóxel situado en el parénquima hepático cuando adquirimos una secuencia eco de gradiente con múltiples tiempos de eco, tanto en fase como en fase opuesta, seremos capaces de resolver, con el modelo adecuado y conociendo la fase de la señal, la cantidad de grasa, hierro y agua que tiene ese vóxel en concreto. Con este método (Martí-Bonmatí L, 2012) se obtienen imágenes paramétricas de la distribución de estos compuestos en el hígado. Las mediciones son fiables tras las correcciones oportunas de la señal, dada la complejidad espectral de la grasa y la influencia que la presencia de hierro y grasa tiene en los valores del primer eco que genera esta señal. Con estos mapas paramétricos obtenidos vóxel-a-vóxel se conoce no sólo la distribución espacial de estos compuestos y sus valores máximos y promedios, sino que también puede analizarse la modificación que sufren con el tiempo y el tratamiento, teniendo un papel muy importante en el estudio de la esteatohepatitis, la sobrecargas de hierro y la hemocromatosis. Los biomarcadores de imagen permiten extraer de las diferentes imágenes médicas adquiridas en los equipos disponibles, distintas características biológicas de una forma objetiva (Buckler AJ, 2011).
Las imágenes digitales extraídas como mapas paramétricos de biomarcadores de imagen representan, vóxel-a-vóxel, no sólo la magnitud de los valores de la característica analizada, sino también su distribución espacial 3D en el interior de un tejido, órgano o lesión determinada.
Estos mapas sintéticos pueden considerarse así como verdaderas biopsias virtuales que muestran las anormalidades objetivadas con una correlación real con el mecanismo biopatológico analizado (Gillies RJ, 2016). Este nuevo paradigma en Radiología da información sobre los diferentes parámetros morfológicos, funcionales, biológicos y de respuesta a una intervención obtenidos por un ajuste matemático numérico y con modelos computacionales de simulación. Permite ver los cambios asociados a la enfermedad y deben ser lo más específicos posibles. Los biomarcadores de imagen proporcionan una información relacionada con la situación biológica particular de un individuo o un paciente para una determinada propiedad analizada. Pongamos un ejemplo guía. Si obtenemos un estudio de perfusión dinámico en Resonancia Magnética mientras se administra un medio de contraste basado en el gadolinio en un paciente con un tumor maligno cerebral, como el glioblastoma, podemos analizar píxel-a-píxel los cambios en la señal producidos por la llegada, distribución y lavado del medio de contraste en la lesión y en el parénquima cerebral adyacente. Si de estas variaciones en la señal, mediante modelos farmacocinéticos adecuados, podemos extraer propiedades de los vasos neoformados, como su permeabilidad y densidad capilar, seremos capaces de predecir la agresividad regional en las distintas zonas del tumor, los diferentes hábitats de comportamiento, dada la relación entre proliferación celular, agresividad y angiogénesis (Padhani AR, 2002). También seremos capaces de diferenciar con esta técnica aquellas zonas peritumorales microscópicamente infiltradas por el tumor, con una mayor expresión farmacocinética, de las que probablemente no lo están ya que su respuesta tisular a la administración del contraste es similar a la del parénquima cerebral normal (Revert Ventura AJ, 2014). Este análisis farmacocinético se ha mostrado también muy útil en la valoración de la neoangiogénesis precoz como expresión de la degeneración del cartílago articular (Sanz-Requena R, 2008; Martí-Bonmatí L, 2009). En este punto debemos insistir en una de las premisas de la radiología cuantitativa. La señal que observamos y reconstruimos en las imágenes provienen de los píxeles y éstos representan tejidos o lesiones complejas con mucha pluralidad interna en sus componentes y propiedades fisicoquímicas. Es decir, los píxeles de interés no son homogéneos, con la excepción de los que representan, por poner un ejemplo, el agua dentro de un quiste simple hepático o renal.
Dados los múltiples factores de confusión, es un factor a tener siempre en cuenta cuando se emplean biomarcadores de imagen. Es por esta diversidad en sus constituyentes que debe garantizarse que las mediciones obtenidas tras los procesos computacionales tienen una relación lo más precisa posible, un coeficiente de correlación intraclases positivo lo más perfecto posible, con la realidad biológica. Hay que tener en cuenta aquí que una correlación positiva perfecta entre las dos variables, la real y la calculada, implica una relación de causalidad aceptable en ausencia de sesgos. La interacción multidisciplinaria entre la Medicina y las ciencias de la computación, dentro del ámbito de la Ingeniería Biomédica, ha permitido abrir nuevas vías en la determinación de las características de la enfermedad. Estas propiedades deben evaluarse correctamente en los distintos escenarios clínicos. Los diferentes equipos y modalidades de adquisición de imágenes generan mucha información contenida implícitamente en las mismas, inherente a su proceso de adquisición. Las técnicas de adquisición y los modelos matemáticos están continuamente en desarrollo y validación para garantizar nuestra capacidad de simular con precisión y representar adecuadamente el estado biofisiológico in-vivo de un tejido o una lesión.
El objetivo final de los biomarcadores de imagen y la radiómica no es más que asegurar una coherencia entre el análisis microscópico in-vitro, el estudio macroscópico in-vivo y la realidad virtual simulada in-silico. Sólo así podrá desarrollar la imagen médica todo su potencial para mejorar la evaluación de la respuesta en los ensayos clínicos, con-tribuir a definir las asociaciones fenotípicas y favorecer las mejoras en el ciclo de salud de los pacientes (Ashton E, 2010; Kurlanda BF, 2012; Krishnaraj A, 2014; Herold CJ, 2015).
En la era de la Medicina personalizada, los biomarcadores de imagen representan el esfuerzo científico de la Radiología para estudiar las propiedades y el comportamiento de las diferentes lesiones y los tejidos, en un intento por describir y observar con exactitud y veracidad las dianas más pertinentes a la enfermedad. Para hacerlo de una forma adecuada, deben aplicarse todas aquellas herramientas informáticas y de minería de datos que permitan analizar los diferentes sistemas biológicos y sus relaciones. La investigación y la innovación en Radiología debe realizarse en equipos de trabajo multidisciplinarios y colaborativos (Herold CJ, 2015; Kang SK, 2015) [1].
[1]https://aprenderly.com/doc/3333467/biomarcadores-de-imagen-y-medicina-personalizada.
LUIS MARTÍ BONMATI. INSTITUTO DE ESPAÑA. REAL ACADEMIA NACIONAL DE MEDICINA BIOMARCADORES DE IMAGEN Y MEDICINA PERSONALIZADA
Aportaciones de la Radiología al Desarrollo de la Medicina y la Mejora del Ciclo de Salud de los Pacientes a través de los Biomarcadores de Imagen