Miocarditis: Diagnóstico por Resonancia Magnética Nuclear Cardíaca
La Miocarditis se define como la inflamación aguda o crónica del tejido miocárdico, focal o difusa, que afecta a cualquier cámara cardiaca. Se incluyó dentro de las miocardiopatías primarias de causa adquirida en la clasificación realizada por la American Heart Association en el año 2006. Posteriormente, la Sociedad Europea de Cardiología clasificó las miocardiopatías en 2008 con un punto de vista más clínico agrupando las enfermedades del miocardio según la forma y función ventricular. La inflamación y/o infección crónica del miocardio puede originar una miocardiopatía dilatada. Si se afecta el pericardio, se produce una miopericarditis, a menudo con derrame pleural y pericárdico asociados. Hasta un 15% de las pericarditis agudas tienen una afectación miocárdica importante. Es difícil establecer su incidencia real porque no es fácil confirmar el diagnóstico en la práctica clínica habitual. Se ha encontrado en el 5-12% de las autopsias de adultos con muerte súbita y en el 1-9% de las autopsias en general. La miocarditis es la causa del 6-8% de las muertes súbitas cardiacas en atletas. La confirmación diagnóstica es difícil porque la historia clínica y la exploración física, las alteraciones en el electrocardiograma (ECG), la determinación de las enzimas cardiacas y el ecocardiograma son poco precisos, y no es infrecuente que se plantee el diagnóstico diferencial con el infarto agudo de miocardio (IAM). Si bien la biopsia endomiocárdica (BEM) se considera la referencia para el diagnóstico de la miocarditis, no está justificada en la mayoría de los pacientes. En estas circunstancias, la resonancia magnética (RM) cardiaca se ha convertido en el método de imagen de elección para diagnosticar la miocarditis, fundamentalmente por su capacidad de caracterización tisular que permite detectar áreas de edema y de fibrosis miocárdica.
En los países desarrollados la infección vírica es la causa más frecuente. Si bien en las décadas de los 80 y 90 los virus más frecuentes eran los enterovirus (coxsackie B), en los últimos 10 años otros virus como el parvovirus B19, el herpesvirus humano 6, el adenovirus, el virus de la hepatitis C, el echovirus, el virus de la inmunodeficiencia humana, el de Epstein-Barr y el citomegalovirus, han cobrado importancia. Otros agentes infecciosos como bacterias, hongos, protozoos (Trypanosoma cruzi [T. cruzi], toxoplasma y helmintos pueden causar miocarditis. Otras posibles etiologías son la tóxica (antraciclinas, ciclofosfamida, traztuzumab, catecolaminas), alcohol, cocaína o radiación, las reacciones de hipersensibilidad (antibióticos, diuréticos como las tiazidas, dobutamina, mesalazina, mordedura de insectos y serpientes), enfermedades sistémicas como las colagenosis, la sarcoidosis, la enfermedad celíaca, la enfermedad de Wegener y la tirotoxicosis.
Desde el punto de vista fisiopatológico las miocarditis pueden dividirse en 3 fases:
1) aguda viral
2) subaguda inmune
3) crónica miocárdica
En la fase aguda el virus alcanza el miocardio por diseminación linfática, hematógena o ambas en un paciente susceptible, y se introduce en el miocito. Es una fase corta y a menudo pasa desapercibida. La proliferación viral en el miocito puede causar daño tisular directo, pero la mayor parte del daño tisular en las miocarditis se produce por la respuesta del sistema inmune al virus cuando llega al miocito. La evolución del paciente va a depender de la respuesta inmune que en los casos extremos da lugar a una respuesta adversa con formación de autoanticuerpos (anticuerpos antimiosina). La persistencia viral puede activar mantenidamente el sistema inmune con el resultado de una inflamación crónica del miocardio, remodelación cardiaca y alteración de la función, que desarrollan una miocardiopatía dilatada. En la fase aguda de la enfermedad hay edema, infiltrados celulares con histiocitos y células mononucleares, con o sin daño de las células miocárdicas. En las fases subaguda y crónica, la fibrosis reemplaza a las células miocárdicas. La presentación clínica es muy variable. El paciente puede estar asintomático, tener síntomas inespecíficos, presentar dolor torácico, insuficiencia cardiaca, arritmias, alteraciones de la conducción, shock cardiogénico o muerte súbita. Los pacientes con miocarditis pueden presentar síntomas parecidos a los del IAM, sobre todo los sujetos jóvenes. Hasta en el 89% de las miocarditis se han descrito síntomas parecidos a los de la gripe, una infección gastrointestinal o de las vías urinarias los días o semanas previos. En la mayoría de los casos el curso clínico de la miocarditis es favorable y cura sin secuelas, pero el 5-10% de los pacientes presentan una evolución desfavorable hacia una miocardiopatía dilatada o muerte súbita. En una revisión de 1.230 pacientes con miocardiopatía de causa inicialmente desconocida, el 9% tenían miocarditis. En el 12% de los pacientes jóvenes que presentaron muerte súbita, la causa fue una miocarditis
La historia clínica, la exploración física, los datos de laboratorio, incluyendo las enzimas cardiacas que pueden elevarse de forma leve o moderada en los pacientes con miocarditis (la creatinfosfoquinasa [CPK, por sus siglas en inglés], la isoenzima MB de la CPK, y sobre todo, las troponinas T e I), y el ECG ayudan a diagnosticar la miocarditis aunque la precisión diagnóstica es baja. El ECG puede ser normal o mostrar alteraciones del ST y de la onda T, ondas Q, bloqueo aurículo-ventricular y bloqueos de rama y arritmias como taquicardia o fibrilación ventricular. Estos hallazgos tienen un valor limitado y una baja especificidad. Debe sospecharse una miocarditis aguda cuando un paciente, especialmente un varón joven, se presenta con anomalías cardiacas inexplicables de reciente comienzo, tales como insuficiencia cardiaca, angina, arritmias o alteraciones de la conducción. Suele ser muy frecuente que refiera una infección viral los días o semanas previos. En muchos casos el diagnóstico diferencial se plantea con el IAM por el dolor torácico, la elevación de las enzimas cardiacas y las alteraciones del ECG1. La BEM con análisis inmunohistoquímico y técnicas moleculares es la referencia para diagnosticar la miocarditis y otras miocardiopatías no isquémicas, pero no se recomienda en la mayoría de los pacientes con miocarditis. Está indicada ante un cuadro de miocardiopatía rápidamente progresiva refractaria al tratamiento o una miocardiopatía de causa desconocida con arritmias que amenazan la vida. Las complicaciones graves de la BEM ocurren en el 0,1-0,5% de los casos (perforación miocárdica y taponamiento cardiaco, bloqueo A-V permanente, IAM, isquemia o infarto cerebral, daño˜ valvular grave y muerte). La tasa global de complicaciones es del 6%. La BEM tiene una sensibilidad y una especificidad limitadas (60 y 80% respectivamente) cuando se toma la autopsia como referente. La tasa de falsos negativos es alta por la gran variabilidad interobservador en la interpretación histológica, y porque las muestras pueden ser insuficientes debido a que los infiltrados inflamatorios son frecuentemente focales y transitorios, y no suelen afectar al ventrículo derecho (la BEM habitualmente se realiza en la cara septal del ventrículo derecho). Un problema adicional es que puede encontrarse genoma viral en el miocardio sin que existan cambios histológicos suficientes que cumplan los criterios de Dallas. Estos criterios tienen una sensibilidad limitada que puede aumentar si se realiza además un estudio inmunohistoquímico y técnicas de patología molecular
Imagen
Ecocardiograma: suele ser la primera técnica de imagen cuando se sospecha una miocarditis. Puede mostrar una alteración global o segmentaria de la contractilidad y una disfunción sistólica del ventrículo izquierdo, que son inespecíficas. El derrame pericárdico se presenta en el 32-57% de los pacientes e indica inflamación activa. En los pacientes con cuadros menos graves el ecocardiograma puede ser normal. Estudios isotópicos (anticuerpos antimiosina marcados con Indio 111 y Galio 67: rara vez se utilizan en la práctica clínica por su escasa resolución espacial, la dosis de radiación que implican y su limitada disponibilidad. Además, la especificidad y valor predictivo positivo son bajos.
Angiografía coronaria: tiene valor para descartar la enfermedad coronaria. No se realiza de forma rutinaria en todos los pacientes con sospecha clínica de miocarditis, solo en aquellos en los que existe una duda diagnóstica con el IAM.
Resonancia magnética: desde las primeras series de casos estudiados con secuencias potenciadas en T2 en el año 1991 y los primeros estudios clínicos con contraste en el año 1998, muchos trabajos han mostrado la utilidad diagnóstica de la RM en los pacientes con miocarditis. La gran ventaja de la RM es que ofrece una triple información: morfológica, funcional y de caracterización tisular. La RM está indicada en los pacientes con síntomas de nueva aparición o persistentes (disnea, ortopnea, palpitaciones, intolerancia al ejercicio y dolor torácico), que presentan datos de lesión miocárdica (disfunción ventricular, alteraciones en el ECG y elevación de troponinas) y en los que se sospecha de una etiología vírica (una infección viral reciente, ausencia de factores de riesgo coronarios y una edad inferior a 35 años). También puede estar indicada en pacientes con alteraciones en el ECG no explicadas por otras causas, aun en ausencia de síntomas de miocarditis. Si se va a realizar una BEM, la RM sirve de guía mostrando las zonas de hiperintensidad de señal en las secuencias potenciadas en T2 y de realce tras la inyección de gadolinio. Algunos estudios sugieren que es mejor hacer la RM cardiaca a partir del séptimo día del comienzo de la clínica, pues durante los primeros días puede ser menos sensible. Esto parece deberse a la afectación focal en los primeros días de la enfermedad, que se hace más difusa a partir del séptimo día y persiste hasta la tercera-cuarta semanas.
El diagnóstico de miocarditis aguda con la RM se basa en varias secuencias:
1. Secuencia eco de gradiente en modo cine (precesión libre en estado estacionario [SSFP, por sus siglas en inglés]). Valora la forma y la función cardiaca. En pacientes con miocarditis aguda se ha descrito un aumento transitorio del grosor y de la masa miocárdica, un aumento del volumen y una disminución de la fracción de eyección del ventrículo izquierdo. También se han descrito alteraciones inespecíficas de la contractilidad segmentaria o global en los casos más graves. Además, puede haber derrame pericárdico.
2. Secuencias eco de espín rápida (FSE, por sus siglas en inglés) de sangre negra potenciadas en T2 (doble inversión-recuperación, triple inversión-recuperación, o short-tau inversion recovery [STIR]) en el eje corto ventricular. Valoran el edema miocárdico, que es conveniente confirmar siempre con al menos un plano ortogonal adicional. El grosor de corte debe ser de 10 mm para tener mayor relación señal/ruido. El edema miocárdico se produce por un aumento de la permeabilidad de la membrana celular con salida del agua intracelular. Se manifiesta como áreas de intensidad de señal aumentada en las secuencias potenciadas en T2, de localización subepicárdica o transmural, parcheadas o difusas. La secuencia puede tener una menor sensibilidad en los casos de inflamación miocárdica leve y por la falta de anulación del flujo lento endocavitario que aparece como áreas de hiperintensidad de señal próximas al miocardio. El análisis puede realizarse de forma visual o cuantitativa. Para la valoración cuantitativa es preferible utilizar la antena de cuerpo en lugar de la antena de superficie cardiaca, pues así la intensidad de la señal es más homogénea. Cuando el edema es difuso puede pasar desapercibido si no se hace un análisis cuantitativo de la intensidad de señal calculando el cociente de edema, o cociente T2 entre la intensidad de señal del miocardio dañado y la intensidad de señal del músculo esquelético, generalmente un músculo para espinal (medido en la misma imagen). Un cociente T2 > 2 sugiere inflamación activa. Con ese valor de corte, el cociente T2 tiene una sensibilidad, especificidad y precisión diagnóstica del 84, 74 y 79% respectivamente. El edema de la fase aguda de las miocarditis y el aumento de la permeabilidad capilar son procesos reversibles y transitorios, y su disminución con el tiempo se asocia a una mejoría de los parámetros de función cardiaca. Otros autores creen que el edema focal sin áreas de realce tardío asociadas puede significar una forma menos grave de lesión que no progresa a necrosis. Otra posible explicación es que el patrón de evolución/resolución del edema miocárdico en las secuencias potenciadas en T2 tenga una ventana temporal diferente de la que tienen las áreas de realce tardío (fig. 1).
3. Secuencia potenciada en T1 sin y con gadolinio para estudiar el realce precoz. Valora el grado de hiperemia y el aumento de la permeabilidad capilar, que en la miocarditis aguda se deben a la vasodilatación en el tejido inflamado, con mayor volumen sanguíneo y acumulación de mayor cantidad de contraste en la fase vascular precoz. Como el gadolinio pasa rápidamente al espacio extracelular, esta fase dura solo unos minutos después de inyectar el contraste. Por ello esta secuencia se realiza durante los primeros 3 min después de la inyección. La mayoría de las veces se utiliza una secuencia FSE de sangre negra, pero también puede hacerse con una secuencia eco de gradiente con un pulso de inversión-recuperación, antes y después de la introducción de gadolinio, en los mismos cortes y con los mismos parámetros.
4. Secuencia de realce tardío. Cuando se ha producido necrosis y/o fibrosis miocárdica, aumenta el espacio extracelular y se concentra más gadolinio en estas zonas. Después de hacer la secuencia de realce precoz se administra una dosis adicional de gadolinio y se realiza una secuencia 2D/3D eco de gradiente con un pulso previo de inversión-recuperación 10-15 min tras la inyección (secuencia de realce tardío) en el eje corto y ejes largos ventriculares. El tiempo de inversión se ajusta individualmente para anular la señal del miocardio sano de modo que las áreas de hiperintensidad de señal indican un daño miocárdico irreversible por necrosis o fibrosis. La extensión espacial del realce tardío se puede calcular (volumen de miocardio con intensidad de señal superior a la intensidad de señal del miocardio normal más 2 desviaciones estándar) y se expresa en gramos (volumen del miocardio que realza con gadolinio multiplicado por 1,05 g/ml, que es la densidad del miocardio). Los programas dedicados a RM cardiaca de las estaciones de trabajo de los equipos de RM suelen incluir el cálculo de este parámetro. El realce tardío en las miocarditis agudas está presente en el 44-88% de los casos, típicamente es subepicárdico con extensión variable al resto del espesor miocárdico, pero no afecta al subendocardio de forma aislada. En las miocarditis, con mucha frecuencia se localiza en la cara inferolateral del ventrículo izquierdo, pero también en los segmentos ántero-septales o septales, o de forma multifocal o difusa. El parvovirus B19 afecta más a la cara lateral del ventrículo izquierdo y el herpesvirus humano 6 al septo interventricular.
En la enfermedad de Chagas el realce tardío se localiza con frecuencia en los segmentos inferolaterales basales y apicales12 (fig. 2). A veces, en las miocarditis activas no se destruye la cantidad de miocitos suficiente para producir necrosis detectable con esta secuencia. Los pacientes con IAM tienen edema miocárdico en el territorio coronario afectado, visible en las secuencias de sangre negra potenciadas en T2.
El realce suele ser más intenso que el de las miocarditis porque, en estas, las áreas de necrosis tisular dentro de los focos de inflamación son más pequeñas que en el IAM37,38 . En los pacientes con un síndrome coronario agudo, un aumento sérico de las troponinas y un cateterismo cardiaco que no muestre lesiones significativas, la secuencia de realce tardío puede ayudar a diferenciar entre una miocarditis (realce subepicárdico), un IAM por émbolos, trombo recanalizado o espasmo coronario (realce subendocárdico en un territorio vascular coronario) y una enfermedad de Tako-Tsubo, que típicamente no muestra realce tardío [1].
Covid19
Preocupa cada vez más que la afección respiratoria aguda que tiene lugar en la enfermedad coronavírica de 2019 (COVID-19) tenga fuerte relación con el daño cardiovascular. Los pacientes con COVID-19 corren el riesgo de sufrir arritmias cardiacas, síndromes coronarios agudos, eventos relacionados con insuficiencia cardiaca y miocarditis fulminante. La lesión miocárdica puede ocurrir en distintas fases de la COVID-19 (p. ej., fases viral, pulmonar, inflamatoria y de recuperación), incluso tardíamente tras el inicio de los síntomas. Aún no se han dilucidado por completo los mecanismos de la afección cardiovascular por SARS-CoV-2, y es probable que sean multifactoriales. Se han identificado partículas virales del SARS-CoV-2 en el tejido cardiaco mediante pruebas de la reacción en cadena de la polimerasa (PCR) en tiempo real, que han proporcionado evidencia de que podría producirse cardiotoxicidad directa. Además, se ha visto que el SARS-CoV-2 establece un dominio de unión al receptor con la enzima de conversión de la angiotensina 2 (ECA2) antes de introducirse en la célula huésped mediante endocitosis. Puesto que más del 7,5% de las células miocárdicas tienen expresión de ECA2 positiva, esto podría influir en la entrada del SARS-CoV2 en los cardiomiocitos y causar cardiotoxicidad directa. Además, la hiperinflamación debida a la liberación de citocinas en la que interviene el virus puede causar inflamación miocárdica y vascular, inestabilidad de la placa, un estado de hipercoagulabilidad y disfunción de las células endoteliales. Por último, en la lesión cardiaca también pueden intervenir otras consecuencias sistémicas de la COVID-19, incluida la sepsis y la coagulación intravascular diseminada. Según biopsias post mortem, las características patológicas del tejido cardiaco van desde alteraciones mínimas a infiltración inflamatoria intersticial y necrosis de los miocitos.
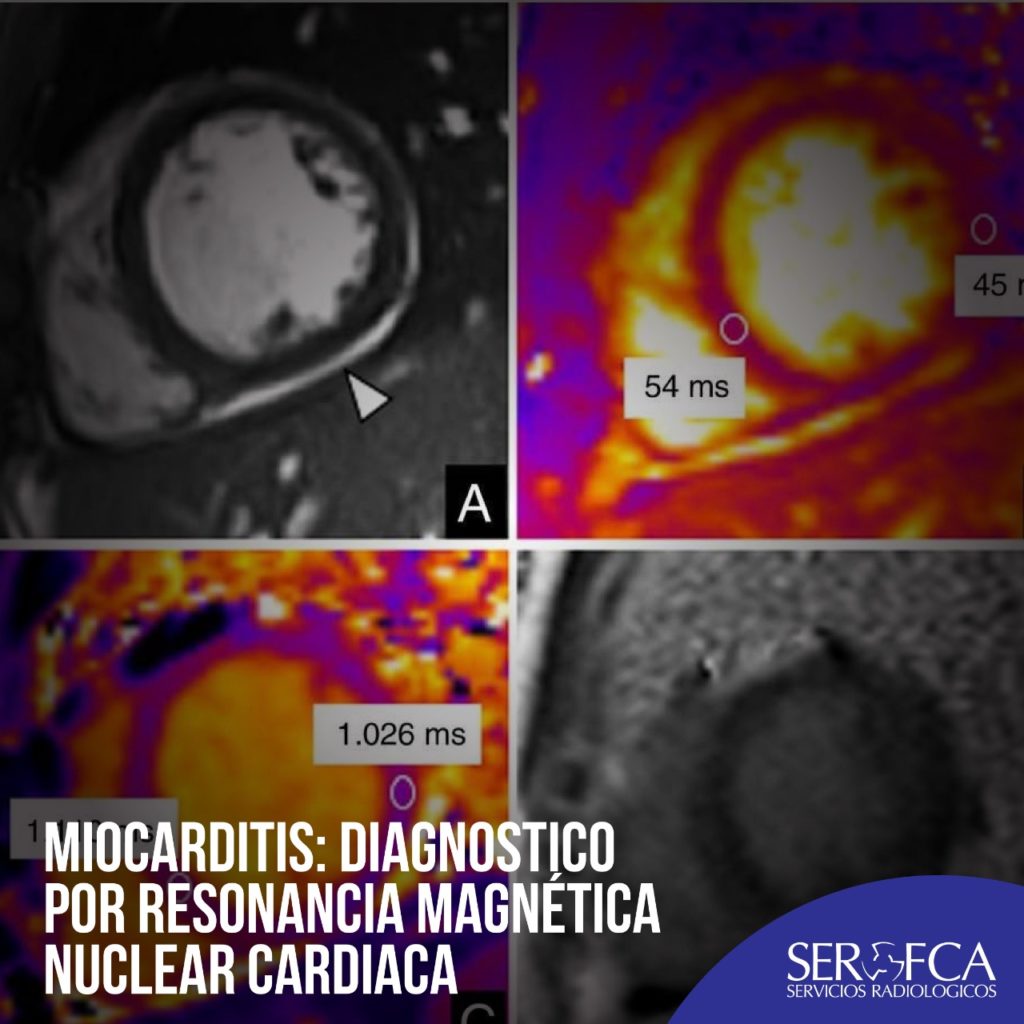
Ejemplo de un paciente varón de 13 años que ingresó tras 2 días de fiebre (40 °c). Informó de tos leve, odinofagia, dolor abdominal y vómitos durante los últimos días. Los análisis mostraron elevación leve de la proteína C reactiva, dímero D, ferritina, péptido natriurético cerebral y concentración de troponina I (190 pg/ml). Las PCR de sus familiares dieron positivo para SARS-CoV-2, y la de él también. El estudio de la RMC realizado con un sistema de 1,5 T (Magnetom Aera, Siemens Healthineers, Alemania) mostró función biventricular conservada, ausencia de alteraciones en la contractilidad regional miocárdica, mapas T2 (54 ms; normal < 52 ms) y valores nativos de mapas T1 (1.110 ms; normal < 985 ms)5 ligeramente aumentados en el tabique ventricular, que reflejaban edema miocárdico, y ausencia de RTG (figura 3 ). Se observó un ligero derrame pericárdico. Se le diagnosticó miocarditis.
La RMC permite evaluar características de la miocarditis tales como la disfunción contráctil, el edema inflamatorio y la necrosis, y se ha convertido en el estándar de referencia para la evaluación no invasiva de la enfermedad. La piedra angular del diagnóstico son las imágenes de secuencias cine convencionales, las secuencias potenciadas en T2, los mapas paramétricos T1 y T2 y las imágenes del RTG. Además, el grado de necrosis miocárdica determinado por el RTG es un buen predictor del pronóstico.
En el contexto de la pandemia de la COVID-19, hay que adaptar el uso de la RMC para permitir prácticas seguras en los estudios urgentes y semisurgentes y el aplazamiento pertinente de las exploraciones programadas. Muchos pacientes con COVID-19 activa confirmada acuden con sospecha clínica de episodios cardíacos inflamatorios o isquémicos y la RMC puede ser una opción eficaz de diagnóstico por imagen para obtener información importante para la toma de decisiones clínicas [2].
[1] A. Bustos García de Castro, B. Cabeza Martínez, J. Ferreirós Domínguez , C. García Villafane y C. Fernández-Golfín Miocarditis: diagnóstico y seguimiento con resonancia magnética. Radiología. 2013;55(4): 294—304 [2] Meylin Caballeros Lam, Ana de la Fuente Villena, Aitor Hernández Hernández, Manuel García de Yébenes, and Gorka Bastarrika Alemañ. Caracterización de la miocarditis por COVID-19 mediante resonancia magnética cardiaca. Rev Esp Cardiol. 2020 Oct; 73(10): 863–864.